研究人员开发新方法来鉴定基于剪接的肝癌生物标志物
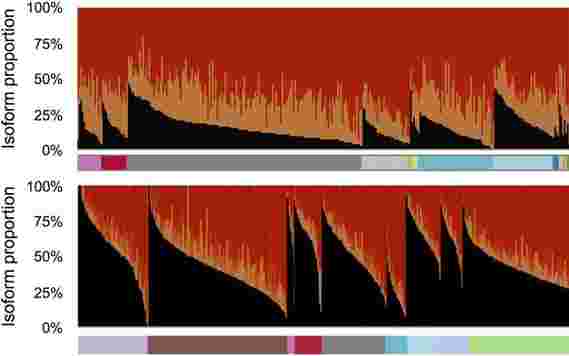
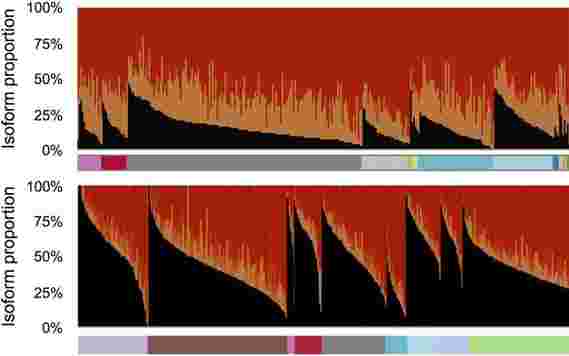
代表了由人类AFMID基因产生的信使RNA的不同版本或同工型,显示了它们在从全身采样的癌性组织(顶部)和非癌性组织(底部)中的相对患病率。黑色峰代表在成年细胞中发现的正常变异,在癌组织中比在正常组织中低得多。相反,颜色标记为橙色和红色的变体适用,它们在肝癌中用作生物标记。
由于肝癌在遗传上特别持久,容易复发,因此确定可以预测疾病进展的生物标志物是抗击肝癌的关键目标。
由CSHL教授Adrian Krainer领导的冷泉港实验室(CSHL)的研究人员现在在基因组研究中报告说,他们已经开发出一种鉴定最常见形式的肝癌,肝细胞癌(HCC)的基于剪接的生物标志物的方法。他们认为该方法也可用于其他类型的癌症。
Krainer说:“这项研究强调了研究RNA剪接变体如何导致癌症的潜力,并指出这些变体是潜在的癌症进展生物标志物。”
剪接是指从基因编码信息复制的RNA信息在能够用作特定蛋白质制造蓝图之前进行编辑的过程。一个基因可以产生多个RNA信息,每个信息都会导致不同的蛋白质变体或“同工型”。许多疾病都与RNA剪接方式的错误或变异有关。剪接中的错误或变异可能导致功能异常的蛋白质或功能不同或异常的蛋白质。
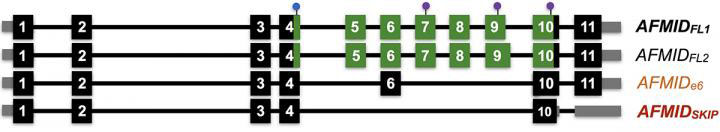
一个基因可以产生多个RNA信息,每个信息导致不同的变异体或同种型。这是人类AFMID基因产生的4种信使RNA亚型。从上到下:通常在成年细胞中发现两种同工型。较低的两个变体在主要亚型中缺少11个片段(称为外显子)中的一些片段。这些产生与肝癌相关的截短蛋白。
最近的研究已经鉴定出肝癌细胞中的剪接不规则性。在CSHL博士后研究员Kuan-Ting Lin的带领下,Krainer的团队开发了一种方法,可以对给定基因产生的所有RNA信息进行全面分析。该团队通过分析从数百名患者中采集的HCC细胞中的RNA信息,在HCC中测试了其剪接变异检测方法。
他们发现,基因AFMID的特殊剪接同工型与患者的生存状况非常差有关。这些变体导致细胞产生AFMID蛋白的截短形式。这些蛋白质的异常形式在成年肝癌细胞中与称为TP53和ARID1A的肿瘤抑制基因突变相关。
研究人员推测,这些突变与参与修复受损DNA的低水平NAD +分子有关。他们建议,将缺失的部分(称为外显子)恢复为AFMID的正常RNA信息,可能会使NAD +升高至正常水平,从而避免TP53和ARID1A发生突变。研究小组希望使用能够与RNA结合的称为ASO(反义寡核苷酸)的小分子,从而改变AFMID的RNA信息的剪接方式。克兰纳(Krainer)的研究小组以前使用这种技术来纠正SMN2基因剪接中的错误,将其作为治疗脊髓性肌萎缩症(SMA)的一种方法。
修复AFMID剪接可导致NAD +的产量增加和DNA修复的增加。“如果我们能够做到这一点,AFMID剪接将成为治疗靶点,并成为治疗肝癌新药的来源,” Lin说。初步实验表明,该小组的工作方向正确。他们证明,哄骗细胞过度表达以正常方式剪接的AFMID会导致更高的NAD +水平和较慢的肝癌细胞生长。
刊物:Lin Kuan-Ting Lin等人,“人类特异性的交替剪接的AFMID亚型开关有助于肝细胞癌中TP53突变和肿瘤复发,” Genome Research,2018年; doi:10.1101 / gr.227181.117
-
神经科学家揭示了无可操作性的性质和培养
2022-01-28 -
科学家揭示了良好的细菌可以控制细胞中的基因
2022-01-28 -
遗传学家完全解码了一个用于再生研究的新基因组
2022-01-27 -
科学家序列最大的基因组到目前为止,腋下基因组
2022-01-26 -
人类学家在史前人的迁移中揭示了新的光线
2022-01-25 -
新发现有助于识别1型糖尿病风险的儿童
2022-01-24 -
与非洲裔美国人的Sema3a基因变种有关的抑郁和酗酒
2022-01-23 -
研究人员使用CrispRup携带的纳米粒子来编辑基因组
2022-01-22 -
新的研究显示皮肤色素沉着比以前认为更复杂
2022-01-22 -
科学家创造了一种更精确的技术来编辑生物体的基因组
2022-01-22 -
耶鲁科学家们对人类大脑的演变表现出微小的差异
2022-01-22 -
Metacherchant软件揭示了抗生素抗性的新原因
2022-01-22 -
生物学家揭示有丝分裂后细胞如何重建
2022-01-21 -
研究人员识别出于发育基因的可逆性“主切换”
2022-01-21 -
研究人员查明了乳腺癌风险背后的分子机制
2022-01-21