神经生物学家揭示了与阿尔茨海默病的关键问题有关的与年龄相关的变化
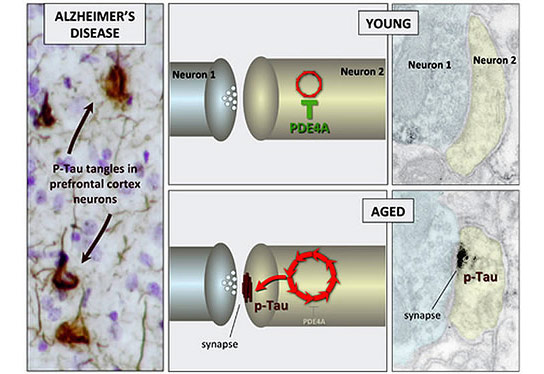
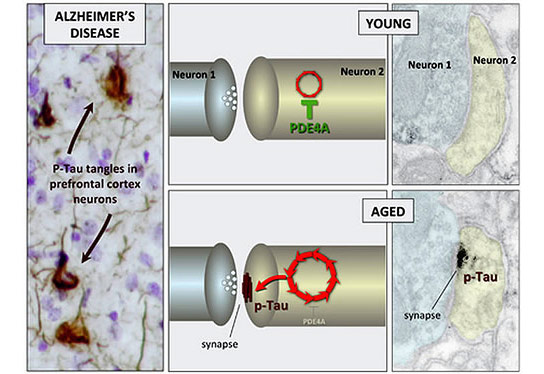
化学“恶性循环”(红色箭头)导致蛋白质Tau的修饰或磷酸化 - 导致神经纤维缠结的原因是阿尔茨海默氏症的标志。在年轻神经元中,该循环被酶磷酸二酯酶PDE4a保持检查。随着先进的年龄,PDE4A丢失,导致损坏的TAU蛋白质的积累。(人类阿尔茨海默病的图形由John Morrison和Patrick Hof提供
在新出版的研究中,神经生物学家揭示了与阿尔茨海默病的关键问题有关的年龄相关的变化。
随着年龄的推进,高度发展的脑电路易于对神经纤维缠结的分子变化感染 - Alzheimer疾病的标志,耶鲁研究人员在3月17日在国家科学院的诉讼程序中报告。
结果不仅有助于解释为什么年龄对阿尔茨海默氏症的危险因素是如此巨大的危险因素,但为什么较高的脑电路调节认知是如此易受变性的,而感官皮质仍未受到影响。
“我们希望了解推进年龄发生的关键分子改变,可以为预防疾病预防提供新的策略,”艾米·艾米斯说:Arnsten,神经生物学教授和该研究的高级作者之一。
神经原纤维缠结由称为Tau的蛋白质制成,当在称为磷酸化的过程中改性时,它变得粘稠和丛集在一起。耶鲁研究发现,磷酸化Tau在老化灵长类动物大脑的高脑电路中收集神经元,但不会积聚在感官皮质的神经元中。研究发现,磷酸化的Tau收集和附近称为突触的兴奋性连接,该研究发现,神经元通信并且可以在更高脑电路中的细胞之间传播。
由耶鲁研究人员领导的研究贝基C.凯洛尔,安妮努斯,阿纳斯滕和康斯坦丁斯D.Paspalas发现了关于Tau与推进年龄磷酸化的导致磷酸化的线索。它们在控制较高皮质连接强度的分子信号中发现的年龄相关变化。在年轻的大脑中,一种称为磷酸二酯酶PDE4a的酶坐在突触附近,当我们处于危险时,它抑制了在危险,切换到更多原始脑区域的行为的控制。他们进一步发现,PDE4A在老年前额叶协会皮质中丢失,释放了增加了增加TAU磷酸化的化学级联。该过程可以在人体中扩增,其中高阶皮质神经元具有更兴奋的连接,导致缠结形成和最终的细胞死亡。
“这对土坑可能影响着阿尔茨海默病的发病和进展的一路的洞察力使我们更接近揭开这种复杂和破坏性疾病的一步,”国家卫生研究院莫莉·瓦格斯特(Holly Wagster)博士的一个混乱这个调查。
新的研究也可能有助于解释为什么头部伤害是阿尔茨海默氏症的危险因素,因为它也可能增加化学“恶性循环”的活动。
“现在我们开始看看是什么让神经元易受伤害,我们可以通过模仿PDE4A的保护作用的治疗来保护细胞,”Arnsten说。
来自耶鲁的其他作者是:Min Wang,Yang Yang,Lu E. Jin,Arthur A. Simen,Brian P. Ramos,Kelly A. Bordner,George E. Craft,Mihovil Pletikos和NenadŠestan。彼得·戴维斯博士是菲因斯坦医学研究所的作者。
该研究由国家老龄化赠款PO1 AG030004研究所提供资助,以及NIH Pioneer奖DP1AG047744至AFTA,耶鲁Kavli神经科学研究所NS奖,以及向CDP的礼物纪念纪念埃莉莉路易斯托兰斯厚朴。
出版物:Becky C. Carlyle,等,“Tau的Tau露营地赋予衰老协会Cortex的变性风险,”2014年PNAS; DOI:10.1073 / pnas.1322360111
图像:人类阿尔茨海默病的图形由约翰莫里森和帕特里克霍夫的疾病提供
-
新药化合物扭转了老鼠脑卒中的大脑缺陷
2021-09-21 -
纳米材料给药免疫细胞抗癌促进
2021-09-21 -
研究人员使用牙齿的干细胞生长脑状细胞
2021-09-20 -
Tufts的生物工程师创造了功能的3D脑状组织
2021-09-20 -
海洋Annelids的视觉系统提供了深入了解眼睛的演变
2021-09-20 -
研究人员展示了帕金森病的治疗和预防潜在的基础
2021-09-19 -
耶鲁研究人员识别肿瘤和健康组织之间的关键环节
2021-09-19 -
研究人员找到了预防体重增加的线索
2021-09-19 -
线粒体可以刺激或停止肥胖
2021-09-19 -
研究人员确定了推动生命多米诺骨牌运动的分子因素
2021-09-19 -
研究人员解决了许多严重疾病的常见成因的生物神秘
2021-09-18 -
物理学家创建并控制基于光子的大型量子力学系统
2021-09-18 -
科学家用新的遗传密码创建生物体
2021-09-17 -
科学家用新的遗传密码创建生物体
2021-09-16 -
研究表明,人脑发育分为三个主要阶段
2021-09-16