耶鲁大学的新研究表明对氧磷酶2促进胰腺癌的生长
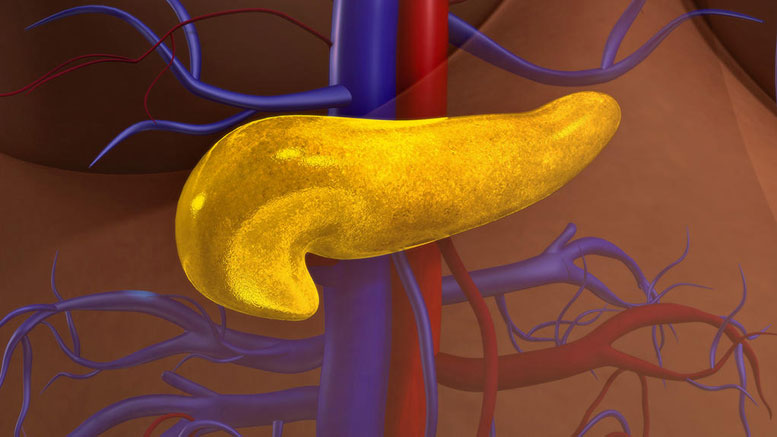
耶鲁大学的一项新研究表明,胰腺癌细胞利用葡萄糖生存并传播到其他器官。
胰腺癌是一种特别致命的疾病,患者几乎没有有效治疗的选择。但一项由耶鲁大学领导的新研究发现了一个对胰腺癌细胞生长至关重要的基因,揭示了新疗法的新靶标。
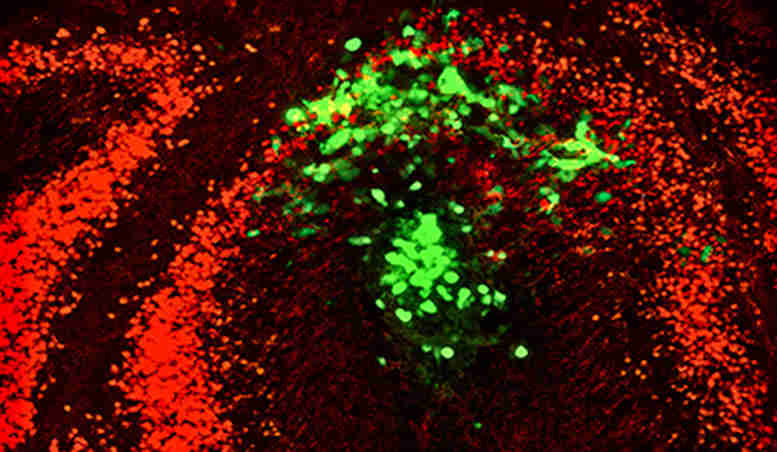
病理学副教授Narendra Wajapayee和他的研究团队首先提出了一个前提,那就是癌细胞需要特定的营养才能生存和快速生长。他们搜索了基因数据集,以发现与正常胰腺组织相比,在胰腺癌组织中高表达的参与代谢调控的基因。在鉴定出的13个代谢基因中,他们将搜索范围缩小到四个,即被阻止时,它们会减少胰腺癌细胞的生长。在动物模型中的进一步研究表明,胰腺肿瘤的生长及其扩散到其他器官(例如肝和肺)需要一个特定的基因PON2。
该研究小组发现,PON2增强了胰腺癌细胞利用葡萄糖的能力,不仅可以生存,还可以在迁移到身体其他部位时蓬勃发展。有了这种见识,Wajapayee和他的同事们正在努力开发抑制剂来阻断PON2和癌症的生长。
阅读《分子细胞》中的全文。
出版物:Arvindhan Nagarajan等人,“ Paraoxonase 2通过刺激GLUT1介导的葡萄糖转运促进胰腺癌的生长和转移,” Molecular cell,2017年; doi:10.1016 / j.molcel.2017.07.014
概括:代谢失调是人类癌症的标志,而胰导管腺癌(PDAC)的糖酵解和谷氨酰胺代谢途径也显示出失调。为了确定PDAC肿瘤生长和转移的新的代谢调节剂,我们使用短发夹RNA系统性地敲除了在人PDAC肿瘤样品中过表达的代谢基因。我们发现,p53转录抑制对氧磷合酶2(PON2),后者调节通过胃抑素的GLUT1介导的葡萄糖转运。PON2的丢失会引发细胞饥饿反应并激活AMP激活的蛋白激酶(AMPK)。反过来,AMPK激活FOXO3A及其转录靶标PUMA,后者诱导失神经抑制PDAC肿瘤的生长和转移。类似于PON2抑制,AMPK的药理或遗传激活可阻断PDAC肿瘤的生长。总的来说,我们的研究结果确定PON2是一种新的葡萄糖转运调节剂,可调节PDAC肿瘤生长和转移所必需的药理学上可操作的途径。
资源:耶鲁大学Ziba Kashef
-
Chandra揭示了早期的黑洞可能已经在拟合和喷射中成长
2022-01-09 -
Chandra揭示了早期的黑洞可能已经在拟合和喷射中成长
2022-01-09 -
Chandra揭示了早期的黑洞可能已经在拟合和喷射中成长
2022-01-09 -
耶鲁大学的新研究表明对氧磷酶2促进胰腺癌的生长
2022-01-09 -
Chandra揭示了早期的黑洞可能已经在拟合和喷射中成长
2022-01-09 -
耶鲁大学的新研究表明对氧磷酶2促进胰腺癌的生长
2022-01-08 -
Chandra揭示了早期的黑洞可能已经在拟合和喷射中成长
2022-01-08 -
物理学家揭示基本力的统一理论
2021-12-26 -
DNA2分子有助于修复与癌症相关的染色体重排
2021-12-25 -
DNA2分子有助于修复与癌症相关的染色体重排
2021-12-25 -
DNA2分子有助于修复与癌症相关的染色体重排
2021-12-25 -
耶鲁大学的科学家揭示了一组遗传性皮肤病的治疗方法
2021-12-15 -
新的T细胞亚群可能会改善癌症的细胞疗法
2021-12-13 -
最新研究表明,对癌症药物的抗药性比单个基因高
2021-12-12 -
最新研究表明,对癌症药物的抗药性比单个基因高
2021-12-12