伯克利实验室识别恶性肿瘤的生物力学因素
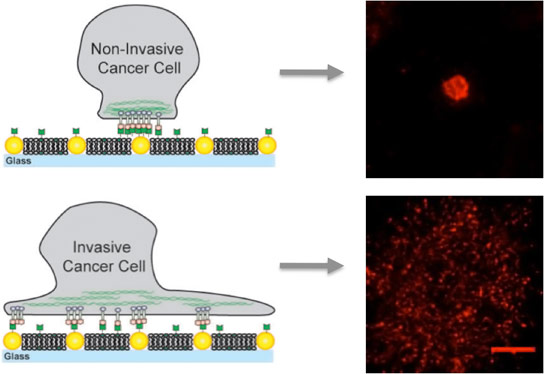
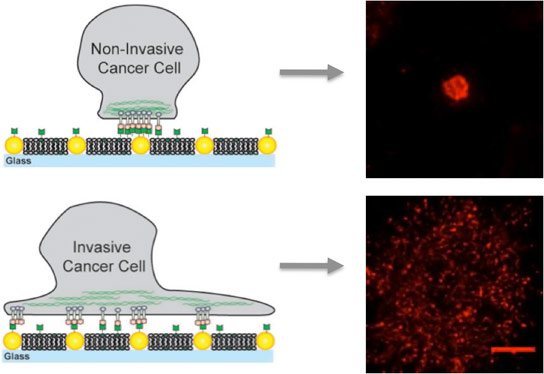
在嵌入金纳多蛋白的人工膜上,非侵入性癌细胞仅粘合到纳米液体上,并在侵入性细胞与膜结合的同时固定,并且纳米块产生有助于转移的移动簇。
在新出版的研究中,来自伯克利实验室的研究人员表明,临界细胞蛋白质系统的恶性活动可能会产生基本上是蛋白质交通堵塞。
证据正在安装癌症的发展和传播,长期归因于基因表达和化学信号传播,涉及生物力学组件。劳伦斯伯克利国家实验室(伯克利实验室)的研究人员通过证明临界细胞蛋白质系统的恶性活性从基本上是蛋白质交通拥堵来产生的恶性活动。
采用独特的人造膜,采用障碍纳米盖的障碍液体,由化学家杰伊林领导的研究团队研究了蛋白质信号络合物epha2 / Ephrin-A1的运输,横跨10种不同的乳腺上皮癌细胞系的表面显示宽范围疾病特征。研究人员发现,这种受体 - 配体综合体的运输在更健康的细胞系中是正常的,但在患病细胞系中被堵塞,在细胞中发生最糟糕的干扰,这是最疾病的细胞。
“epha2蛋白质在与癌细胞的恶性行为中聚集在一起的细胞表面上会聚集在一起,epha2蛋白聚集在一起,”甚至可以有助于癌细胞的恶性行为。““各种乳腺癌细胞系中EphA2传输的差异干扰及其与疾病特性的相关性表明Epha2聚类本身可能有助于病理效应。”
Groves拥有伯克利实验室的物理生物学司和UC Berkeley的化学部门的联合任命,也是霍华德休斯医学院(HHMI)调查员。他是一篇论文的相应作者,描述了符合“纳米障碍阵列的南级障碍阵列的南级障碍阵列欧洲癌细胞系中欧洲癌细胞系中的欧洲圆锥母细胞系中的欧洲圆锥体阵列的射击传输”。本文的共同作者是Theobald Lohmuller和钱旭。
Epha2属于一系列酶,是细胞过程的关键调节因素。Ephrin-A1是与EphA2结合的信号蛋白。EphA2 / Ephrin-A1的复合物将聚集在簇中,然后在细胞表面上运输。Epha2的过表达已与许多人类癌症有关,但在乳腺癌中尤为突出。
“约有40%的乳腺癌患者表现出与肿瘤转移相关的Epha2的过表达,因此,大量努力旨在瞄准epha2的治疗方法,”Groves说。“然而,正如欧安科对病理细胞行为有助于病理细胞行为的错误,因为Epha2通常在癌细胞中不突变。”
Groves是Methobiology的新兴领域的领先权力,旨在了解细胞感觉如何感觉和反应机械力量。为了探讨Epha2中可能的机械因子在Epha2的乳腺癌中,Groves使用他的小组的技术,其中由脂质分子的流体双层组成的人工膜嵌入着固定的金纳多仪。这允许研究人员控制蛋白质的间距或转运和放置在膜上的其他细胞分子。
对于这项研究,Groves和他的同事使用了金纳多仪的阵列,以向Epha2 / Ephrin-A1集群的运动和组装呈现定义的障碍。Ephrin-A1配体可以与膜结合,膜允许簇是移动,或者固定簇的纳米蛋白,或者纳米蛋白质。研究人员用乳腺癌细胞的线,具有相似水平的EphA2表达,并包括MDA-MB-231,高度侵入性和致瘤线,以及MCF10A,相对良性和非致瘤线。
“当我们看到具有相同级别的EPHA2的单元格,但MDA-MB-231在MCF10A没有卡住时,那么我们可以说它超出了EPHA2的数量,即EPHA2已插入的方式。 “格罗维斯说,进入剩下的细胞中的剩余细胞。“我们的观察结果表明细胞骨架是罪魁祸首,调节细胞骨架的药物也可能治疗epha2聚类,从而降低病理行为。”
该研究主要由国家癌症研究所支持。
出版物:Theobaldlohmüller等,“纳米级障碍阵列挫败了癌细胞系中癌细胞系中的epha2-ephrin-a1簇的传输,”2013年纳米字母; DOI:10.1021 / NL400874V
图像:劳伦斯·伯克利国家实验室
-
触发识别阿尔茨海默病的发作
2021-09-05 -
纳米增强生物传感器可检测单个癌症蛋白
2021-09-04 -
科学家实时地同行了一个细胞
2021-09-04 -
抗体将骨髓干细胞直接转化为脑细胞
2021-09-04 -
合成硅酸盐纳米粒子刺激干细胞进入骨细胞
2021-09-04 -
移植的干细胞恢复记忆和学习小鼠
2021-09-04 -
研究人员小鼠逆转糖尿病症状
2021-09-04 -
研究人员认为P2Y2受体分子作为转移的网关
2021-09-03 -
新技术将皮肤细胞转化为功能性脑细胞
2021-09-03 -
新形式的放射癌疗法没有副作用
2021-09-03 -
新数据提供了生命的起源的线索
2021-09-03 -
羽扇豆推出泊沙康唑缓释片
2021-09-02 -
拜耳与Atara合作开展CAR-T细胞疗法
2021-08-22 -
帝斯曼与艾薇儿组建合资公司,开发植物蛋白
2021-07-28 -
学习:烟酰胺可恢复真皮细胞的健康代谢
2021-07-07